Un diamante NON è per sempre, la grafite sì
💎 Ti sarà senz’altro capitato di sentire il celebre slogan: “Un diamante è per sempre”. Se ti dicessi che questo slogan non vale se preso alla lettera? Un diamante non è per sempre ma la grafite sì! Scopriamo perché...

Ti sarà senz’altro capitato di sentire il celebre slogan: “Un diamante è per sempre”. Se ti dicessi che questo slogan non vale se preso alla lettera? Un diamante non è per sempre ma la grafite sì! Sapevi che sono convertibili l'uno nell'altro e che sono caratterizzati dalla stessa composizione chimica? Se vuoi soddisfare la tua curiosità, continua a leggere!
Lo slogan
Era il 1947 quando comparve nella pubblicità dei gioielli di De Beers, un noto colosso americano, lo slogan “a diamond is forever”, creato da Frances Gerety, copywriter di una nota agenzia pubblicitaria dei tempi. Ebbe così tanto successo da meritare un premio ed essere riutilizzato in numerosi contesti inerenti ai diamanti nell’oreficeria, staccandosi poi totalmente dal marchio a cui era stato assegnato ed entrando a far parte della cultura pop.

Qualche anno fa la De Beers ha addirittura cercato di riappropriarsi del suo motto perché ormai si era scisso totalmente dal marchio per cui era stato creato, grazie alla potenza del suo messaggio.
Ora proviamo a mettere una lente scientifica sul celebre slogan e rispondiamo alla domanda se un diamante duri davvero per sempre. La risposta è: no, un diamante non è per sempre. La grafite sì.
Diamante e grafite: allotropia
Dal loro aspetto e proprietà fisiche non si direbbe ma il diamante e la grafite sono fatti esattamente dagli stessi ingredienti: atomi di carbonio. Le loro differenze sono dovute al modo in cui sono disposti gli atomi di carbonio nella struttura e, quindi, ai legami chimici e alle forze intermolecolari. Questo fenomeno prende il nome di allotropia: nello specifico la materia che compone diamante e grafite è la stessa, ma varia il modo in cui gli atomi sono disposti nello spazio e i legami che li tengono insieme.
Nel diamante gli atomi di carbonio sono legati covalentemente fra di loro e disposti in una rigida struttura tetraedrica, che conferisce al diamante trasparenza.
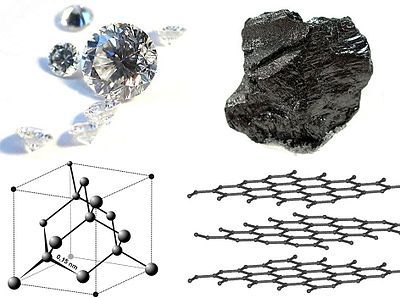
Nella grafite, invece, gli atomi di carbonio sono disposti in lamelle esagonali stratificate. Su ogni strato gli atomi di carbonio sono legati in maniera covalente fra di loro mentre i singoli piani sono tenuti insieme tramite le interazioni di Van der Waals, per questo è facile che si sfaldi. I singoli piani di grafite prendono il nome di grafene. In maniera generica, possiamo dire che diamante e grafite sono due forme polimorfe. Il polimorfismo è un caso più generico di allotropia, esso si riferisce a una sostanza che si presenta in forme cristalline diverse.
La termodinamica svela l’arcano: il secondo principio
Il diamante è una forma termodinamicamente instabile dei composti del carbonio proprio per la sua struttura rigida e ordinata (dal basso grado entropico): rema contro il secondo principio della termodinamica secondo cui i sistemi che raggiungono l’equilibrio lo fanno massimizzando l’entropia, ovvero aumentando il grado di disordine.
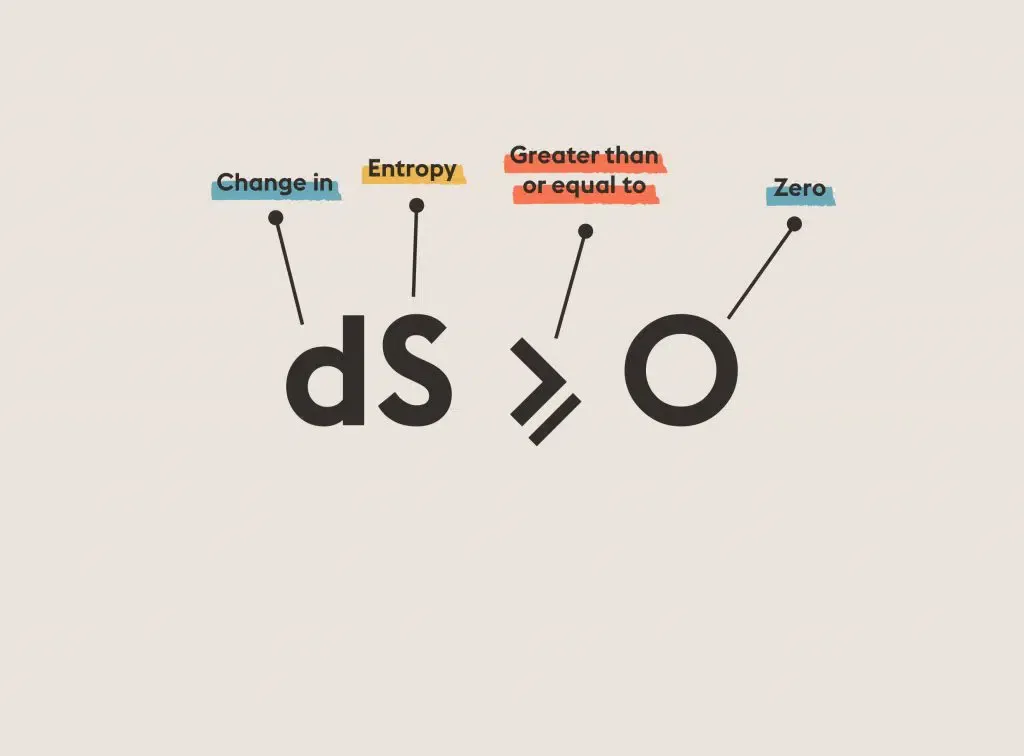
Pertanto, se l’universo tende al raggiungimento dell’equilibrio con un massimo grado di disordine, allora viene da sé che una struttura come quella del diamante, altamente ordinata e organizzata non possa durare “per sempre”. Per il secondo principio della termodinamica il diamante dovrebbe spontaneamente evolversi in grafite, la forma allotropica che abbiamo visto essere termodinamicamente più stabile a condizioni standard (Temperatura di 25°C e pressione di 1 atm). Allora come è possibile che i diamanti nella scala di vita umana durano per “molto” tempo?
Obiezioni cinetiche: la metastabilità
Abbiamo introdotto tempo nel nostro discorso e si sa che quando entra il tempo nelle nostre equazioni dobbiamo parlare di cinetica del processo. Ebbene, in condizioni di temperatura e pressioni standard, occorrerebbero bilioni di anni per trasformare un solo centimetro cubico di diamante in grafite! La trasformazione non è rapida perché la cinetica non la sostiene: sarebbe necessario rompere spontaneamente la struttura tetraedrica per effettuare una traslazione degli atomi di carbonio al fine di farli disporre lungo singoli piani di grafite e sarebbe un’operazione ad alto dispendio energetico, pertanto, la struttura del diamante è cineticamente stabile. Si parla di metastabilità quando un composto instabile termodinamicamente è stabile cineticamente.
Quindi, in condizioni di temperatura e pressione standard il diamante è metastabile.
Andando, però, in condizioni di bassa pressione (20 GPa che corrispondono a 197385 atm) e di alte temperature (1900 K) e atmosfera inerte, la forma allotropica del diamante muta repentinamente in grafite!

Conclusioni
Abbiamo visto che un diamante non dura per sempre. L’allotropia è uno dei topic più affascinanti della chimica, permette di toccare con mano quanto la differente interazione fra atomi di uno stesso elemento dia differenti proprietà alla materia. Come per una ricetta, non contano solo gli ingredienti ma anche il modo in cui vengono assemblati.
Andreana Balsamo
Sitografia
- https://www.ninjamarketing.it/2015/06/12/de-beers-a-diamond-is-forever/
- https://goldbook.iupac.org/terms/view/D01671
- https://it.wikipedia.org/wiki/Diamante
- https://it.wikipedia.org/wiki/Polimorfismo_(chimica)
- https://chemistry.stackexchange.com/questions/34193/are-diamonds-really-forever#:~:text=This%20activation%20energy%20tells%20us,centimeter%20of%20diamond%20to%20graphite
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
