Antibiogramma: cos'è e a cosa serve
🔬 Lo sapevi? L'antibiogramma è un test di laboratorio utile a saggiare la sensibilità di un microrganismo a uno o più farmaci antimicrobici
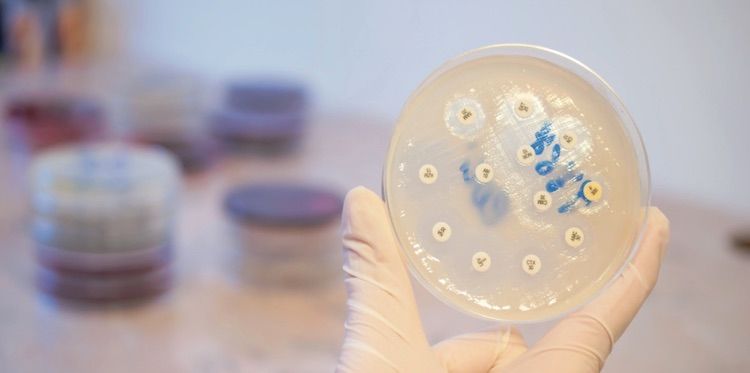
L’antibiogramma (ABG) è un esame microbiologico condotto in vitro utilizzato per saggiare la sensibilità di un microrganismo a uno o più farmaci antimicrobici.
In particolare, tale test di laboratorio è particolarmente prezioso poiché permette di orientare in maniera ottimale la terapia antibiotica e di monitorare l’evoluzione della resistenza batterica, limitando, difatti, la problematica della multiresistenza.
Procedura
In caso di sospetta infezione, si procede al prelievo dei campioni colturali indirizzati ad un laboratorio biologico dove saranno successivamente analizzati.
Specificamente, i campioni raccolti possono essere di varia natura:
- sangue per le emocolture;
- urine per l’urinocoltura;
- broncoaspirato;
- tamponi effettuati sulle ferite;
- liquido pleurico o peritoneale.
A questo punto, il materiale raccolto viene inviato al laboratorio di microbiologia di competenza, dove verrà predisposto un terreno di coltura per valutare l’eventuale presenza di microrganismi.
In caso di effettiva crescita di uno o più microrganismi, il campione viene messo a contatto con dischetti imbevuti di antibiotico. Dunque, a seconda del comportamento del microrganismo a contatto con il principio attivo del farmaco, si indentifica l’antibiotico più efficace per quel batterio.
In particolare, l’obiettivo dell’antibiogramma è valutare la resistenza o la sensibilità del microrganismo ai vari antibiotici. In particolare, quando un microrganismo è sensibile ad un antibiotico significa che la somministrazione di quella molecola è in grado di debellarlo. Al contrario, se è resistente, l’antibiotico in questione sarà inefficace.
Tecniche
Per valutare la sensibilità o la resistenza di un batterio ad un determinato antibiotico vi sono molteplici tecniche. Nello specifico:
- Tecnica per diffusione mediante l’utilizzo di dischetti: ha lo scopo di individuare la classe di antibiotici o l’antibiotico specifico a cui risulta sensibile il microrganismo di interesse;
- Tecnica per diluzione: permette di valutare la minima concentrazione di uno specifico antibiotico in grado di inibire la crescita batterica.
Metodo per diffusione-test di Kirby-Bauer
In questa tecnica si procede impregnando un disco di carta assorbente con un volume noto e una concentrazione appropriata di antimicrobico.
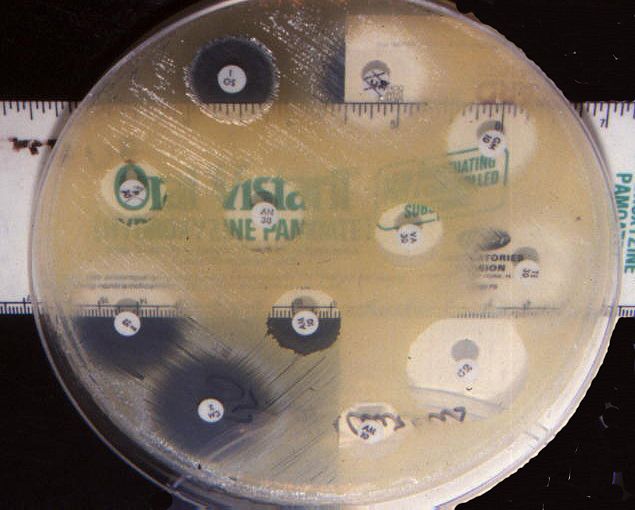
Successivamente, si pone il suddetto disco di carta su una piastra di agar per testare la sensibilità dell’organismo inoculato nel terreno. Quindi, l’antimicrobico diffonde dal disco al terreno.
In particolare, la crescita dell’organismo in esame è inibita a una distanza dal disco che è proporzionale alla suscettibilità dell’organismo.
La validità di questa tecnica attentamente standardizzata dipende dall’utilizzo di dischi con un contenuto antimicrobico corretto, un inoculo che dia una crescita confluente e un agar Mueller Hinton ottimale.
Dopo l’incubazione a 35 °C per 16–18h, le dimensioni delle zone di inibizione della crescita vengono misurate e interpretate utilizzando gli standard NCCLS (National Committee for Clinical Laboratory Standards). Questi ultimi sono derivati dalla correlazione che esiste tra le dimensioni delle zone di inibizione e le MIC (minima concentrazione di antibiotico in grado di inibire la crescita batterica).
Specificamente, i ceppi sensibili all’antimicrobico sono inibiti a una cospicua distanza dal disco, mentre quelli resistenti hanno zone di inibizione più piccole o crescono fino al bordo del disco.
Inoltre, se attorno al punto in cui viene seminato l’antibiotico si crea un alone bianco e trasparente, allora il microrganismo responsabile dell’infezione è sensibile al farmaco. Se invece, le colonie del microrganismo continuano ad estendersi, si riscontra resistenza all’antibiotico utilizzato.
Nello specifico, il diametro dell’alone in millimetri è correlato alla sensibilità del batterio all’antibiotico. Quindi, maggiore è l’alone e maggiore sarà la sensibilità del batterio all’antibiotico e viceversa.
Metodo per diluizione
Il metodo per diluizione consente di valutare la resistenza batterica ad un singolo antibiotico in concentrazioni crescenti e permette di calcolare la minima concentrazione di antibiotico in grado di inibire la crescita batterica e la minima concentrazione battericida.
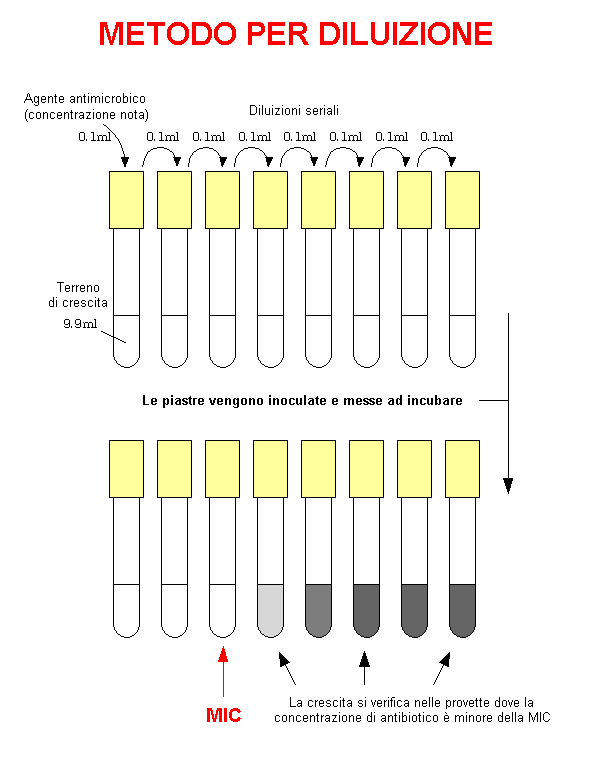
Come prima cosa, occorre preparare una serie di provette contenenti un terreno di arricchimento liquido. A questo punto, si procede facendo delle diluizioni seriali dell’antibiotico preso in esame, di modo da ottenere una serie di provette aventi concentrazioni decrescenti di quest’ultimo.
In seguito, l’inoculo batterico preso in considerazione viene seminato in ogni provetta a concentrazione costante. Quindi, s’incubano le provette a 37 °C per 24h.
Per riscontrare la crescita batterica occorre valutare la torbidità delle singole provette, corrispondente ad un indice importante che attesta lo sviluppo di colonie batteriche.
Specificamente, le provette con una minore concentrazione di antibiotico presenteranno una maggiore torbidità, indice di una cospicua crescita batterica. In particolare, man mano che l’antibiotico aumenta si riscontrerà una progressiva diminuzione della torbidità del terreno.
La prima provetta individuata contenente un terreno limpido, corrisponderà alla minima concentrazione di antibiotico in grado di inibire la crescita batterica (MIC).
MIC e MBC
Una volta misurata la MIC è possibile anche determinare la concentrazione minima battericida (MBC) che corrisponde alla più bassa concentrazione dell’antibiotico in esame necessaria a provocare la morte di più del 99.9% di un dato microrganismo.
In questo caso, è necessario piastrare ed incubare il materiale di ogni provetta in singoli terreni di coltura. Ovviamente, in ogni terreno si riporterà la concentrazione dell’antibiotico preso in esame. Quindi, dopo 24h si andrà a valutare la crescita batterica.
La crescita nel terreno di coltura diminuirà all’aumentare della concentrazione dell’antibiotico presente nelle provette. In particolare, il primo terreno in cui non viene riscontrata crescita batterica corrisponderà alla provetta contenente una quantità di antibiotico sufficiente per uccidere tutti i batteri presenti al suo interno. La MBC può essere uguale o maggiore della MIC.
Risultati attesi
Nel metodo per diffusione i risultati possono essere letti dopo 18h di incubazione. Successivamente, si misurano le dimensioni delle zone di inibizione con un righello o un calibro includendo il diametro del disco.
A questo punto, utilizzando le linee guida CLSI (Clinical and Laboratory Standards Insitute), è possibile determinare la suscettibilità o la resistenza dell’organismo a ciascun farmaco testato.
Infine, in base alla tabella di interpretazione, per ogni antibiotico bisogna indicare e registrare se la dimensione della zona di inibizione indentifica il microrganismo suscettibile (S), intermedio (I) o resistente (R).
Invece, nel metodo per diluizione la minima concentrazione inibente la crescita del batterio in esame corrisponde alla provetta in cui è presente la più bassa concentrazione di antibiotico in grado di inibire lo sviluppo e la crescita microbica.
Inoltre, nel referto dell’antibiogramma viene sempre indicato:
- la tipologia di campione prelevato;
- il microrganismo/i isolato/i;
- la carica batterica di ognuno, indicata in CFU/ml (unità che formano la colonia/ml);
- i vari antibiotici associati al valore della MIC (minima concentrazione inibente)
- sensibilità, sensibilità intermedia o resistenza del microrganismo all’antimicrobico.
Limitazioni del Test
I test di sensibilità misurano l’attività antimicrobica contro i batteri in condizioni di laboratorio (in vitro), non nel paziente (in vivo).
Quindi, non si può presumere che un antimicrobico che uccide o previene la crescita in vitro di un organismo possa essere un trattamento altrettanto efficace in vivo.
Inoltre, la tecnica Kirby-Bauer deve essere utilizzata:
- solo per specie batteriche ben valutate;
- non è adatta per batteri a crescita lenta, che necessitano di nutrienti speciali o che richiedono CO2 o incubazione anaerobica;
- deve essere necessariamente associata alla metodica per diluizione per identificare la minima concentrazione inibente (MIC).
La selezione di un trattamento antimicrobico appropriato implica anche la considerazione delle condizioni cliniche del paziente.
Ancora, è necessario conoscere l’attività dei diversi farmaci inclusi i loro tassi di assorbimento, diffusione nei tessuti, metabolismo, escrezione e anche la possibile tossicità e gli effetti sulla normale flora microbica del paziente. Infine, è opportuno tenere in considerazione anche il costo e la disponibilità di un farmaco.
Giovanna Spinosa
Fonti
- https://www.nurse24.it/studenti/dispense-e-piani-assistenziali/antibiogramma-cosa-e-a-cosa-serve.html#:~:text=L’antibiogramma%20(ABG)%20%C3%A8,inibitoria%20(minimal%20inhibitory%20concentration).
- Guidelines for Routine Antibiotic Susceptibility testing (AST) – Learn Microbiology Online (microbeonline.com)
- Basic sets of drugs used in routine Antimicrobial susceptibility testing (AST) – Learn Microbiology Online (microbeonline.com)
- Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) – Learn Microbiology Online (microbeonline.com)
- Broth dilution method for MIC Determination – Learn Microbiology Online (microbeonline.com)
- Modified Kirby-Bauer disc diffusion method for Antimicrobial Susceptibility Testing – Learn Microbiology Online (microbeonline.com)
- Antimicrobial Susceptibility Testing (AST)- Types and Limitations (microbenotes.com)
- https://www.microbiologiaitalia.it/test-microbiologici/antibiogramma/
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
